등록 : 2019.05.28 10:46
수정 : 2019.05.28 11:28
 |
|
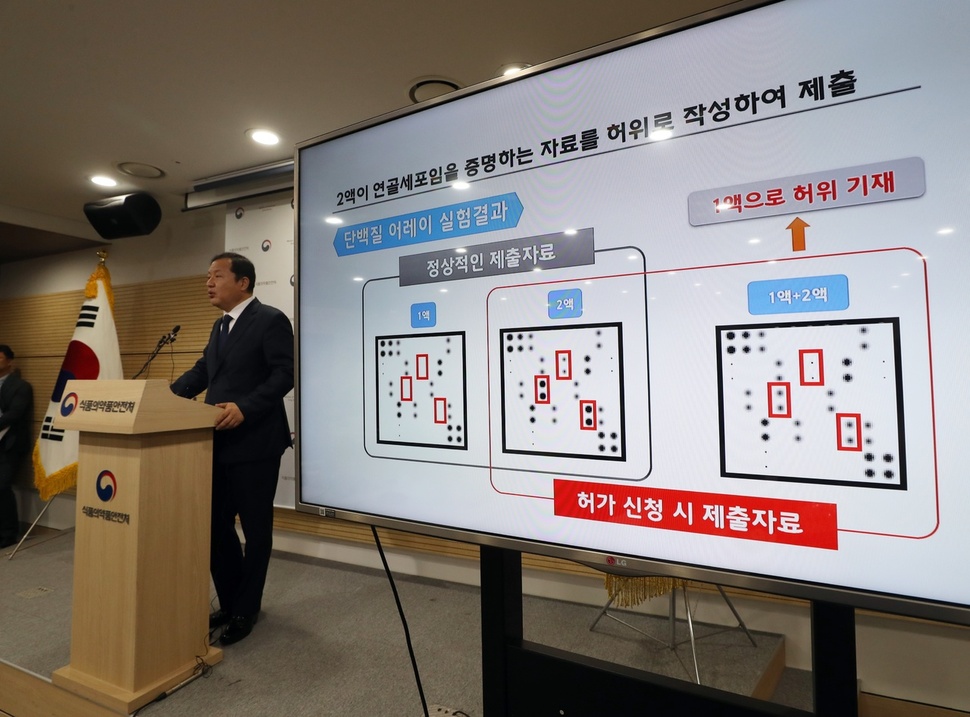
28일 오전 청주시 흥덕구 오송읍 식품의약품안전처에서 강석연 바이오생약국장이 의약품 성분이 뒤바뀐 골관절염 유전자치료제 ‘인보사케이주'(인보사)에 대한 조사 결과를 발표하고 있다. 청주/연합뉴스
|
 |
|
28일 오전 청주시 흥덕구 오송읍 식품의약품안전처에서 강석연 바이오생약국장이 의약품 성분이 뒤바뀐 골관절염 유전자치료제 ‘인보사케이주'(인보사)에 대한 조사 결과를 발표하고 있다. 청주/연합뉴스
|
관절염 치료에 있어 주요 기능을 가진 세포가 종양을 일으킬 수 있는 세포로 바뀐 사실이 드러나 안전성 논란이 일고 있는 인보사케이주(인보사)에 대한 보건당국의 허가가 취소됐다. 이 주사를 최고 700만원을 내고 맞은 환자들은 25억원에 이르는 손해배상청구 소송을 제기할 예정이다.
식품의약품안전처(식약처)는 28일 성장 속도가 빠르다는 연골세포가 종양을 일으킬 수 있는 신장유래세포(293유래세포)로 바뀐 사실이 드러난 인보사에 대한 허가를 취소하고 인보사의 제조사인 코오롱생명과학을 형사고발 한다고 밝혔다. 인보사의 허가 당시 제출한 자료에 기재된 연골세포가 아닌 신장세포로 최종 확인된 것은 물론 코오롱생명과학이 제출했던 자료가 허위로 밝혀졌다는 것이다.
그동안 식약처는 허가 당시 제출한 자료의 진위 등을 확인하기 위해 코오롱생명과학에 연골세포가 신장세포로 바뀐 경위와 이유를 입증할 수 있는 자료를 제출하도록 요구했고, 식약처의 자체 시험검사, 코오롱생명과학에 대한 현장조사, 지난 20~24일 미국 임상시험에 대한 현지실사 등을 시행했다. 조사 결과 코오롱생명과학은 허가 당시에 허위자료를 제출했고, 신장세포로 바뀐 경위와 이유에 대해서도 과학적인 근거를 제시하지 못했다.
이 주사를 맞은 환자 안전 대책에 대해 식약처는 임상시험 대상자에 대한 장기추적 관찰 결과 약물과 관련된 중대한 부작용이 없었고 전문가 자문회의를 종합해 볼 때 현재까지 인보사의 안전성에 큰 우려는 없는 것으로 판단하고 있다고 밝혔다. 다만 만약의 경우 발생할 수 있는 부작용에 대비하기 위해 식약처는 전체 투여 건수인 3707건에 대해 15년 동안 장기 추적조사를 추진하고 있다고 덧붙였다.
인보사 주사를 맞은 환자 244명은 이날 오후 서울중앙지방법원에 공동소송 소장을 접수할 예정이다. 소송을 대리하는 법무법인 오킴스는 지난 한 달 동안 인보사 주사를 맞은 환자들을 모집한 결과 375명의 투약 환자들이 소송에 참여한다는 의사를 밝혔고 이 가운데 소장접수 서류가 완비된 244명부터 우선 소송을 제기한다고 밝혔다. 손해배상 청구금액은 위자료와 주사제 가격 등을 고려해 총 25억원 수준이지만 변론과정에서 손해배상청구 금액이 더 늘어날 가능성이 있다고 덧붙였다. 이 사건을 담당하는 엄태섭 변호사는 “환자들이 겪고 있는 정신적 고통은 인간의 가장 기본적이고 중요한 자신의 건강과 생명에 대한 공포는 물론 사실을 은폐하며 책임회피에 급급한 코오롱에 대한 분노까지 더해졌다”며 “이제 골리앗과의 싸움이 시작된 만큼 승소로서 환자들에게 작은 위로를 전하기 위해 최선을 다하겠다”고 밝혔다.
김양중 의료전문기자
himtrain@hani.co.kr
광고



기사공유하기